- 聯系我們

聯系電話:0571-86198618手機: 18058734169 (微信同)手機:18868735317(微信同)周一至周日 8:00~22:00
在線客服周一至周日 8:00~22:00
-
《醫療器械臨床試驗質量管理規范》第25號 《醫療器械臨床試驗質量管理規范》是醫療器械臨床試驗工作指導性和規范性文件,是醫療器械臨床試驗申辦方、研究機構、研究者及相關服務機構必須熟知并遵從的基本要求。 時間:2019-9-7 8:35:10 瀏覽量:3987

-
醫療器械拓展性臨床試驗管理規定征求意見 8月28日,國家藥品監管局就《醫療器械拓展性臨床試驗管理規定(征求意見稿)》(以下簡稱《征求意見稿》)公開征求意見。《征求意見稿》共六章31條,對醫療器械拓展性臨床試驗的權益和責任、啟動條件、過程管理、數據收集等進行了明確規定。 時間:2019-9-2 22:28:55 瀏覽量:2688

-
國家藥監局綜合司公開征求《醫療器械拓展性臨床試驗管理規定 (征求意見稿)》意見 為貫徹落實中共中央辦公廳、國務院辦公廳《關于深化審評審批制度改革鼓勵藥品醫療器械創新的意見》(廳字〔2017〕42號)精神,國家藥監局組織起草了《醫療器械拓展性臨床試驗管理規定(征求意見稿)》,面向公眾征求意見。 時間:2019-8-29 20:15:52 瀏覽量:2710
-
醫療器械臨床試驗檢查要點及判定原則 醫療器械臨床試驗現場檢查時保證臨床試驗質量的一個重要方式,根據《醫療器械注冊管理辦法》和《醫療器械臨床試驗質量管理規范》等要求制定本檢查要點及判定原則,用于指導醫療器械臨床試驗現場檢查工作。 時間:2019-8-27 0:00:00 瀏覽量:4341

-
淺談醫療器械臨床試驗評價 根據《醫療器械監督管理條例》的規定,申請第二類、第三類醫療器械產品注冊,應當提交臨床評價資料,雖然《醫療器械監督管理條例修正案(草案送審稿)》(以下簡稱《修正案》)中提及第二類醫療器械原則上可不再進行醫療器械臨床試驗和臨床評價,但由于該《修正案》尚處于送審階段,并未正式實施,因此,現階段下醫療器械的臨床評價資料仍然是醫療器械注冊申報過程中必須提交的資料之一。 時間:2019-8-19 23:22:33 瀏覽量:3452

-
創新醫療器械臨床試驗審批的實踐與思考 近期,醫療器械技術審評中心(以下簡稱“中心”)審評四部對進入創新醫療器械特別審批程序的“可降解鎂骨內固定螺釘”產品的臨床試驗審批申請開展了技術審評工作。根據中心審評工作程序,采用項目小組“三分法”審評模式開展技術審評工作,配備相應專業背景的審評人員,分別審查生物醫學工程部分、生物學評價部分和臨床試驗方案部分。 時間:2019-8-18 16:56:34 瀏覽量:2556

-
《醫療器械臨床試驗質量管理規范》解讀 為加強醫療器械臨床試驗的管理,維護醫療器械臨床試驗?過程中受試者權益,保證醫療器械臨床試驗過程規范,結果真實、科學、可靠和可追溯,根據《醫療器械監督管理條例》,食品藥品監管總局會同國家衛生和計劃生育委員會制定頒布了《醫療器械臨床試驗質量管理規范》,國家局專門撰文對此規范進行官方解讀。 時間:2019-8-17 21:01:31 瀏覽量:3984

-
怎么找醫療器械臨床試驗機構? 對于醫療器械注冊,如果產品不能豁免臨床的話,臨床試驗機構的選擇直接關系著醫療器械注冊進程、時間、費用,以及是否能夠通過審評。如何找到有資質的臨床試驗機構呢?我們可以很方便的從醫療器械臨床試驗機構備案管理信息系統中找到符合要求的機構。 時間:2019-8-16 0:00:00 瀏覽量:3253

-
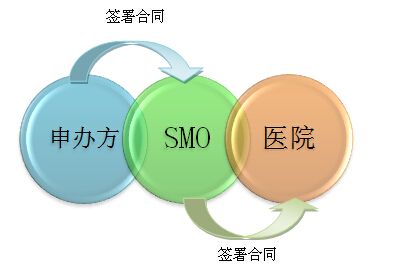
醫療器械臨床試驗各階段CRC主要工作事項 隨著國家醫療器械臨床試驗監管的日趨完善和嚴厲,CRC在醫療器械臨床試驗合規、質量、進程中扮演著關鍵角色,CRC工作的質量很大程度上決定臨床試驗的成敗。那么,CRC在醫療器械臨床試驗各階段主要工作時什么呢? 時間:2019-8-15 16:06:06 瀏覽量:7590
-
醫療器械臨床試驗中不依從/違背或偏離方案報告的問題分析及解決措施 醫療器械臨床試驗的方案依從性,保證臨床試驗的質量,對涉及人的生物醫學研究過程中不依從/違背或偏離方案倫理審查中存在的問題進行分析,并提出解決措施。 時間:2019-8-13 0:00:00 瀏覽量:7054

-
第三類醫療器械臨床試驗倫理問題案例探討 醫療器械臨床試驗是指在經資質認定的醫療器械臨床試驗機構中,對擬申請注冊的醫療器械在正常使用條件下的安全性和有效性進行確認或者驗證的過程[2]。植入性第三類醫療器械臨床試驗因其難度大、風險高,對臨床試驗中受試者安全與權益的保護顯得尤為重要。 時間:2019-8-12 0:25:18 瀏覽量:4042

-
《醫療器械臨床試驗質量管理規范》解讀 根據《醫療器械監督管理條例》,國家食品藥品監督管理總局會同國家衛生和計劃生育委員會制定頒布了《醫療器械臨床試驗質量管理規范》(以下簡稱《規范》)。該《規范》將于2016年6月1日實施。 時間:2019-8-10 20:28:37 瀏覽量:2852

-
創新醫療器械臨床試驗審批的實踐與思考 近期,醫療器械技術審評中心(以下簡稱“中心”)審評四部對進入創新醫療器械特別審批程序的“可降解鎂骨內固定螺釘”產品的醫療器械臨床試驗審批申請開展了技術審評工作。 時間:2019-8-9 0:06:31 瀏覽量:2744

-
醫療器械臨床試驗 之 醫療機構臨床檢驗項目匯總(體液、血液) 臨床檢驗是將病人的血液、體液、分泌物、排泄物和脫落物等標本,通過目視觀察、物理、化學、儀器或分子生物學方法檢測,從而為臨床、為病人、為醫療器械臨床試驗提供有價值的實驗資料。臨床檢驗是一門多學科互相滲透、交叉融合的綜合性應用學科,涉及化學、物理學、生物學、生物化學、免疫學、微生物學、生理學、病理學、遺傳學、分子生物學、統計學和多門臨床醫學等學科。 時間:2019-8-8 8:25:44 瀏覽量:4333

-
如何進行醫療器械臨床試驗稽查? 臨床稽查分為項目稽查、系統稽查、供應商稽查(比如:CRO公司選擇、中心實驗室選擇等),一般情況下針對醫療器械臨床試驗機構的項目稽查居多。政策和執法尺度不斷在變化,項目稽查可以從臨床試驗中機構選擇、臨床試驗操作到臨床試驗結束貫穿整個臨床試驗的全部過程,依照現行法規對臨床試驗項目進行全方位的稽查。 時間:2019-8-6 0:00:00 瀏覽量:3655

-
我國對醫療器械臨床試驗資料保存時限的要求? 《醫療器械臨床試驗質量管理規范》第十章 第九十一條規定,臨床試驗機構應當保存臨床試驗資料至臨床試驗結束后10年。申辦者應當保存臨床試驗資料至無該醫療器械使用時。 時間:2019-8-6 1:21:29 瀏覽量:20649

-
《醫療器械臨床試驗質量管理規范》的主要內容介紹 為加強醫療器械臨床試驗的管理,維護醫療器械臨床試驗過程中受試者權益,保證醫療器械臨床試驗過程規范,結果真實、科學、可靠和可追溯,根據《醫療器械監督管理條例》,食品藥品監管總局會同國家衛生和計劃生育委員會制定頒布了《醫療器械臨床試驗質量管理規范》(以下簡稱《規范》)。 時間:2019-8-4 21:50:33 瀏覽量:3547

-
浙江省醫療器械臨床試驗管理備案流程 根據《中共中央辦公廳 國務院辦公廳印發〈關于深化審評審批制度改革鼓勵藥品醫療器械創新的意見〉的通知》和《國務院關于修改<醫療器械監督管理條例>的決定》規定,醫療器械臨床試驗機構由資質認定改為備案管理。2017年聯合原衛生計生委發布了《醫療器械臨床試驗機構條件和備案管理辦法》,建立醫療器械臨床試驗機構備案管理信息系統,并于2018年1月1日起同時實施啟用。 時間:2019-8-3 23:30:55 瀏覽量:6908

-
關于征求對《免于進行醫療器械臨床試驗目錄(2019年修訂稿征求意見稿)》意見的通知 8月1日,國家藥監局器審中心發布《免于進行臨床試驗醫療器械目錄(2019年修訂稿征求意見稿)》,共996種醫療器械和420種體外診斷試劑免于進行醫療器械臨床試驗。 時間:2019-8-1 0:00:00 瀏覽量:4846

-
醫療器械臨床試驗中關于 PI 的案例分析 醫療器械臨床試驗中,PI (主要研究者)是關鍵性人物,往往決定了臨床試驗的成敗。在試驗進行的過程中,經常會發生一些意想不到的情況,以下歸納了圍繞PI發生的一些突發情況,以便討論在實際工作中遇到類似的情況,應當如何應對和處理。 時間:2019-7-31 0:00:00 瀏覽量:15312

